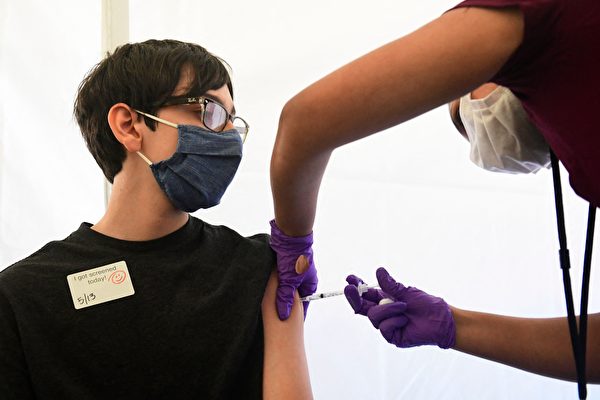
【大纪元2022年03月08日讯】(大纪元记者李梅综合编译)3月1日,美国食品和药物管理局(FDA)发布了与辉瑞疫苗紧急授权相关的10,000页文件。这是在联邦法官发布命令后释出的第一批编辑后文件,原文件总量估计约400,000页。
已公布的文件还包括相关的动物研究信息、受试者经历的不良事件及接种后感染中共病毒(COVID-19)的文件;有关研究方案的信息及对方案做的修改;辉瑞COVID内部审查委员会的信息;向美国卫生与公众服务部(HHS)提交的用于销售COVID疫苗的原始报告等。文件可在“公共卫生和医疗专业人员寻求透明度”(Public Health and Medical Professionals for Transparency,简称PHMPT)机构的网站上查阅。
PHMPT控告FDA 辉瑞要求加入诉讼
PHMPT组织依据“信息自由法”(FOIA)要求公开文件。该组织表示,对所发布的数据不持任何立场,所收到的任何数据都会在网站上公开,允许独立专家进行审查和分析。PHMPT是由公共卫生专业人员、医疗专业人员、科学家和记者组成的非营利组织,旨在为获取和传播FDA用于批准COVID-19疫苗的数据,目前已有近600位专家在网站上签名加入PHMPT。
PHMPT最早由30多位哈佛、耶鲁和加州大学分校等医疗机构的公共卫生专业人士和科学家组成,在FDA批准辉瑞疫苗后(2021年8月23日)第四天就要求公布“辉瑞疫苗的所有数据和信息”,包括安全性和有效性数据、不良反应报告以及疫苗的活性和非活性成分的列表。
但FDA拒绝其请求,辩称没有足够人力来处理数十万页文件的编辑和发布,声称每月只能处理500页,至少需要75年才能完成。而根据联邦法律,FDA应在批准疫苗的同一天公布文件。
2021年9月16日,PHMPT对FDA提起诉讼。美国德州北区法院的联邦法官马克‧皮特曼(Mark Pittman)在2022年1月6日的命令中,要求FDA在1月31前发布12,000页和辉瑞疫苗相关的文件;此后每月再发布55,000页文件。但辉瑞于1月21日向法院递交备忘录,称愿协助FDA发布相关文件,以避免信息被“不当披露”。如果其请求获准,相关文件将被延迟到5月1日后披露。不过PHMPT的律师在1月25日要求法官拒绝辉瑞的动议。2月2日,皮特曼法官拒绝了辉瑞公司的请求,做出了更新裁决。
因此,FDA必须按照时间表发布编辑后的文件:在2022年3月1日或4月1日之前,公布10,000页;在5月2日、6月1日和7月1日前各公布80,000页;在8月1日前,公布70,000页;之后每月第1个工作日披露50,000页,直到公布全部文件。
已披露的辉瑞疫苗文件
此前,FDA已释出少量文件。据希腊独立记者和研究员迈克尔‧内夫拉达基斯(Michael Nevradakis)文章,最早的500页文件于2021年11月释出,揭示了安全问题及辉瑞疫苗在发布后90天内发生超过1,200例相关死亡,该文件还包括同一时期发生的9页不良事件报告。
发表在制药专业“端点新闻”(Endpoints News)的一篇文章,认为新公布的文件不值一顾。作者扎卡里‧布伦南(Zachary Brennan)表示,这些文件包含了“超过100页的匿名安全相关数据表”和“身份不明的受试者的性别、年龄、体重和身高比BMI”。该文件涉及辉瑞向FDA支付的近290万美元的标准用户费和“疫苗的机密的非临床概述”;以及一些“通常不会向公众发布”的快速通道指示信和辉瑞要求豁免疫苗名称中加后缀的请求。
今年2月8日,辉瑞发布了2021年的收益报告,仅其被命名为Comirnaty的COVID-19疫苗,就为辉瑞创造了367.8亿美元的收入,辉瑞全年收入为813亿美元。
辉瑞首席财务官弗兰克‧达梅里奥在一份声明中表示,“在2021年我们生产了超过30亿剂Comirnaty疫苗”,这是为社会创造巨大价值的一年,是一项前所未有的里程碑意义的成就。辉瑞预计2022年将生产40亿剂COVID-19疫苗。
FDA批准辉瑞疫苗的声明
2021年8月23日,FDA正式批准了首个COVID-19疫苗,即适用于16岁及以上人群的辉瑞疫苗(Pfizer-BioNTech COVID-19 Vaccine)。此前,该疫苗于2020年12月11日经FDA“紧急使用授权”(EUA)已经开打,并于2021年5月10日同样在EUA下开始给12—15岁青少年施打,也为某些免疫功能低下人群打第三剂加强针。
据FDA网站,代理局长珍妮特‧伍德科克(Janet Woodcock)于正式发布日表示,虽然通过EUA就意味着达到FDA严格的科学标准,且数百万人已安全地接种了该疫苗;但FDA的正式批准有助某些公众对辉瑞疫苗的“安全性、有效性和高标准的制造质量”增添信心。FDA的批准也为各级政府和卫生机构要求人们接种疫苗提供了依据。
据“sciencealert.com”文章,该疫苗商品名Comirnaty当中的“rna”代表了信使RNA(mRNA)。据FDA的解释,疫苗含有这种遗传物质,人体可据其制造导致COVID-19的一种病毒蛋白质,而免疫系统就会对COVID-19病毒产生防御反应,但“Comirnaty中的mRNA仅在短时间内存在于体内,不会被整合进DNA、不会改变人体的遗传物质”。FDA表示,临床试验证明该疫苗在预防COVID-19方面“有效率为91%”,分别有22,000人接种了疫苗和安慰剂,在各选取约20,000人的有效数据对比后,发现接受第二剂疫苗者在第一周内没有感染病毒的证据。该试验对超过一半的参与者进行了至少4个月的跟踪,对大约12,000名疫苗接种者至少追踪了6个月。
FDA表示,经严格评估确认,辉瑞疫苗会使罹患心肌炎和心包炎的风险增加。特别是在第二剂接种后7天内,与女性和老年男性相比,40岁以下男性的风险更高,而12—17岁的男性风险最高。
不过,与辉瑞合作的Vestavia研究集团的区域主管布鲁克‧杰克逊(Brook Jackson)曾在2020年秋天通过电子邮件向FDA举报辉瑞临床实验中的违规行为。据“bmj.com”2021年11月的报导,她在发邮件的当天被解雇,这是她20年研究生涯中头一次被解雇。Ventavia其后与辉瑞签约,为其进行四项疫苗接种临床研究,包括儿童、年轻人、孕妇的COVID-19疫苗和加强剂量的试验。◇
责任编辑:方平#